Sebastian Balser
Functionalized Nanomembranes – From Material Science to Bio Applications
Stand der Forschung
Die Strukturaufklärung von Biomolekülen ist die Grundlage für einen großen Bereich der heutigen pharmakologischen und medizinischen Forschung, da sie uns Aussagen über die Funktion von Proteinen und DNA ermöglicht und so die Bausteine des Lebens untersucht werden können. Eine Methode zur Strukturaufklärung ist die Kryo-Elektronenmikroskopie (KryoEM). Hierbei wird die zu untersuchende Probe mittels eines stark-fokussierten Elektronenstrahls beschossen und aus den entstehenden Signalen eine Struktur errechnet.Funktionalisierte Membranen sind für die strukturbiologische Untersuchung mittels Kryo-Elektronenmikroskopie (KryoEM) von diversen Systeme, wie Enzymen, Proteinen und Bakterien eine Möglichkeit, um immer bessere Auflösungen zu erreichen.1 Gleichzeitig stellt die Herstellung und Funktionalisierung dieser Membranen eine große Herausforderung an die Materialwissenschaft und Chemie dar, da die Membranen nur wenige Nanometer dick sein dürfen, sehr stabil sein sollten und gleichzeitig viele weitere Anforderungen erfüllen müssen.1 Dass die Entwickler der KryoEM 2017 mit dem Nobelpreis ausgezeichnet wurden,2 zeigt den aktuellen gesellschaftlichen Nutzen dieser Methode.1
Im Rahmen meiner Promotion soll, aufbauend auf bisherigen, schon patentierten Modellen in der Herstellung von neuartigen Nanomembranen, die Funktionalisierung der entwickelten Membranen und besonders die Verbesserung der biologischen Anwendbarkeit im Vordergrund stehen. Die Membranen sollen die native Umgebung einer Zellmembran nachahmen können, um Messungen noch akkurater zu gestalten.
Hierbei sollen die Membranen in einem Bottom-Up Prozess ausgehend von selbstassemblierenden Monoschichten (SAMs) auf mit Gold beschichteten Silizium-Wafern in einem sukzessiven Verfahren hergestellt werden.
Dazu wird disulfid-funktionalisiertes Polyglycerol, ein biorepulsives Polymer, auf die Goldober-fläche aufgebracht und mit einem Quervernetzer behandelt. Anschließend kann diese dünne Schicht in einem mehrstufigen Prozess von dem rigiden Silizium-Substrat abgetrennt werden und auf eine beliebige andere Oberfläche transferiert werden. Wird diese nur ca. 5 nm dicke Schicht auf ein löchriges Transmissionselektronenmikroskopienetz (TEM-Netz) platziert, entsteht eine frei stehende, mikroporöse Nanomembran, die hauptsächlich aus biorepulsiven Polyglycerol besteht (siehe Abb.1).1
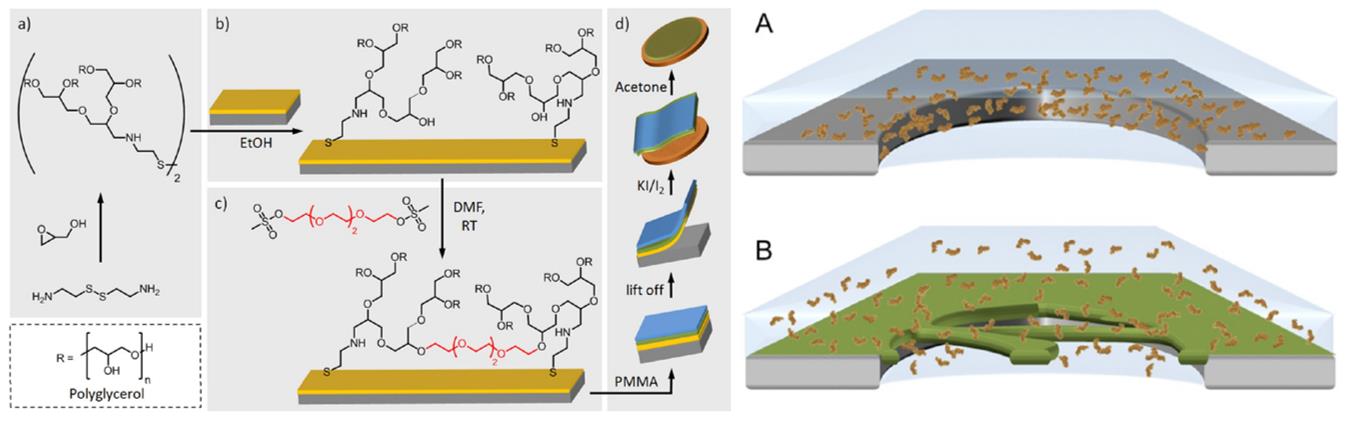
Abb.1: Links ist die Fabrikation von löchrigen Membranen basierend auf quervernetztem Polyglycerol (PG) dargestellt. Im ersten Schritt (a) wird das disulfid-funktionalisierte PG hergestellt, anschließend wird es auf eine Goldoberfläche aufgebracht (b) und schließlich mittels eines Linkers quervernetzt (c). In einem mehrstufigen Ätz-Prozess wird die Membran von der Goldoberfläche getrennt (d). Im rechten Bild ist zu erkennen, wie diese löchrigen Membranen über ein dünnes TEM-Netz gespannt werden können und wie die Proteine in den Löchern sich anlagern können (B). Dies ist bei nicht-löchrigen Membranen (A) nicht der Fall. Hier lagern sich die Proteine am Rand der Netzporen aufgrund hydrophober Wechselwirkungen an und können so schlechter untersucht werden.1
In den Mikrometer großen Poren dieser Membran können sich nun die Proteine anlagern und sind somit durch die regelmäßige Porosität gleichmäßig verteilt, was zu mehr möglichen räumlichen Anordnungen führt und somit bessere Auflösungen ermöglicht. Die Biorepulsivität der Membran verhindert, dass sich die Proteine auf der kompletten Oberfläche verteilen und agglomerieren.1 Diese Membranen und ihr Herstellungsprozess wurden in den letzten zwei Jahren im Arbeitskreis Terfort von Scherr et al. entwickelt und patentiert.1 Dieses Membransystem bietet die Möglichkeit Proteine zu untersuchen, die vorher nicht strukturell aufklärbar waren und vorhandene Strukturen mit einer höheren Auflösung zu vermessen.1
Forschungsschwerpunt
Im Rahmen meiner Promotion sollen verschiedene biofunktionalisierte Membranen mit dem Ziel eines Baukastensystems hergestellt werden. Dazu können kontinuierliche Membranen mit diversen Affinitätsstellen der Biochemie ausgestattet werden. Folgende Affinitätsmarker sollen verwendet werden:
|
- His-Tag-Systeme3,4 - Click-Chemie-Systeme5,6 |
- Biotin/Streptavidin-Systeme4,7 - Antikörper-Strategien8,9 |
Alle oben genannten Systeme haben sich in den verschiedensten Gebieten der Chemie und Biochemie über die letzten Jahrzehnte etabliert, da sie sehr zuverlässig und effizient funktionieren. Hier soll nur beispielhaft das His-Tag System dargestellt werden, um das Prinzip der Affinitätsmarker in Bezug auf die Nanomembranen darzustellen.
In Abb. 2 ist zu erkennen, wie auf einem Siliziumwafer mit einer 200 nm Goldschicht ein biorepulsives PG Netzwerk aufgebaut werden kann.10,11 Die bisherige Membranherstellung (siehe Stand der Forschung) sieht hier nun die Trennung der PG-Schicht vom festen Support vor. Durch den Prozess des Membran-Transfers entstehen poröse Nanomembranen.11 Jedoch besteht die Möglichkeit bei kontinuierlichen Membranen, diese vorher zu funktionalisieren indem eine synthetisch hergestellte Bioerkennungssequenz basierend auf NTA-Funktionalitäten an die PG-Schicht angebracht wird.10
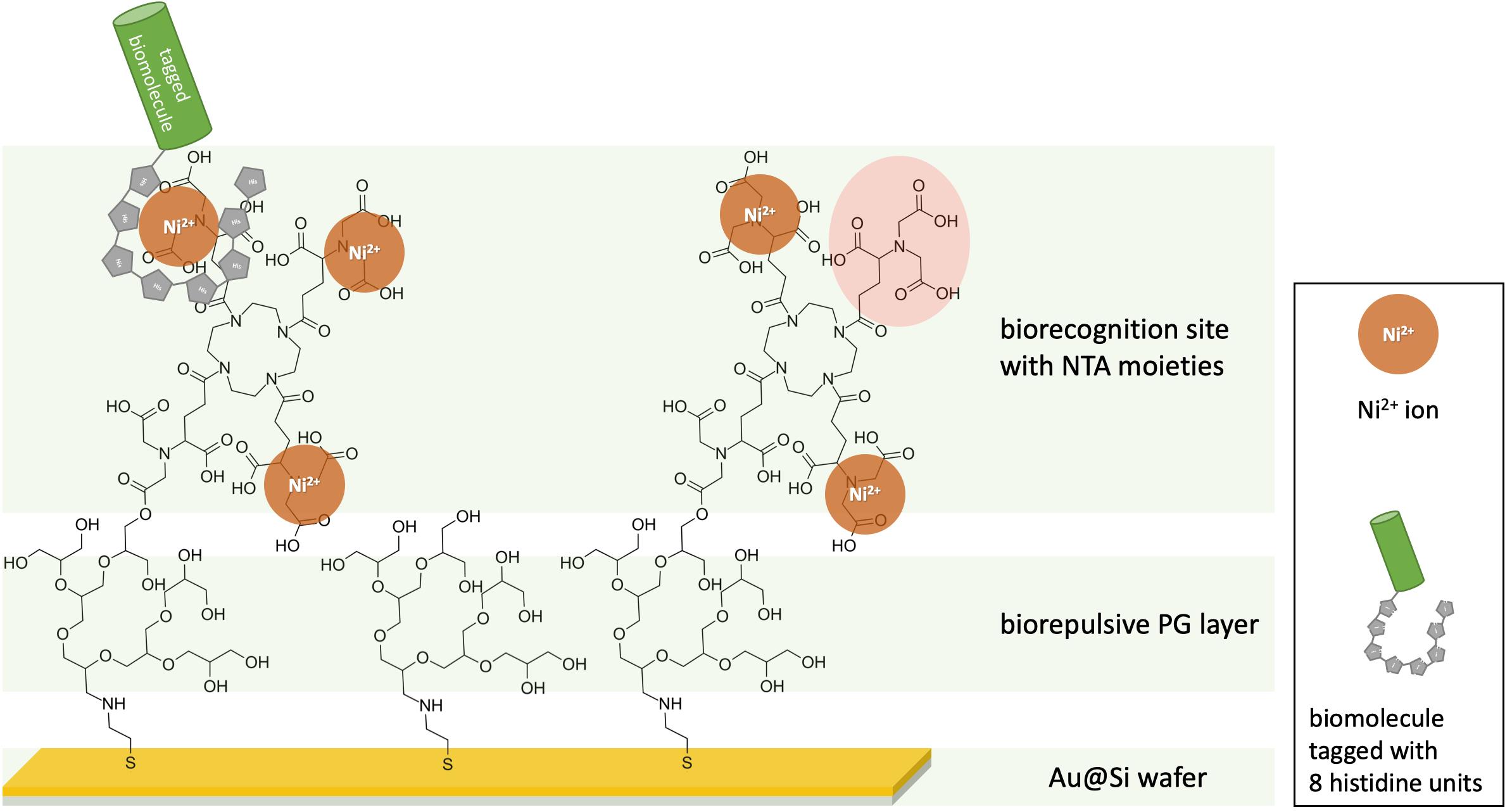
Abb.2: Funktionalisiertes Schichtsystem aufbauend auf einer PG-Schicht, welches über NTA-Funktionen Ni2+-Ionen binden kann. Dadurch lassen sich Biomoleküle, die mit His-Tags ausgestattet sind, selektiv auf der Oberfläche immobilisieren. Wird die Bindung zum festen Gold-Substrat getrennt, können so freistehende funktionalisierte Nanomembranen erhalten werden.10
So soll es möglich sein freistehende PG-Membranen mit NTA-Anbindungsstellen zu erhalten. Diese Anbindungsstellen können entweder vor oder auch nach der Trennung mit z.B. Nickel-Ionen aktiviert werden. Werden diese Membranen nun in Kontakt mit Histidin-markierten Proteinen gebracht, können diese spezifisch an die Membran angebunden werden und so selektiv untersucht werden.10
Dieses Beispiel erläutert die generelle Strategie, die schließlich ein Baukastensystem ermöglicht, um diverse Klassen von Biomolekülen, wie Proteinen und Enzymen, mittels KryoEM zu untersuchen. So sind auch die oben vier aufgelisteten Strategien nur eine kleine Auswahl an möglichen Affinitätsmarkern, welche fortgehend erweitert werden können.
Methoden
Im Rahmen meiner Promotion kombiniere ich eine Bandbreite an synthetischen und analytischen Methoden, um zuerst die oben genannten Membranen mit bioaktiven Molekülen zu funktionalisieren und schließlich mittels diversen analytischen Methoden, wie Infrarotreflexionsabsorptionsspektroskopie (IRRAS), Ellipsometrie, Quarzkristall-Mikrowaage (QCM), Oberflächenplasmonenresonanzspektroskopie (SPR), Rasterelektronenmikroskopie (SEM), Rasterkraftmikroskopie (AFM), sowie KryoEM zu untersuchen. Die Funktionalität der Proteinselektivität soll anhand von Modellsystemen mit z.B. Proteinen, die His-Tag modifiziert worden sind, untersucht werden. Dazu eignen sich besonders Derivate des grün fluoreszierenden Proteins (GFP), welches mit einem His-Tag funktionalisiert werden kann. Der Vorteil solcher Proteine ist die Vielfalt der hier möglichen Detektionsmöglichkeiten, wie z.B. QCM und SPR, als auch Fluoreszenzmikroskopie.
Bachelorarbeiten & Masterpraktika
Im Rahmen von Bachelorarbeiten sowie Masterpraktika können sowohl synthetische als auch oberflächenanalytische Themen bearbeitet werden. Auch eine Kombination beider Bereich ist je nach Zeit- und Gestaltungsrahmen möglich.
Literatur
(1) Scherr, J.; Parey, K.; Klusch, N.; Murphy, B. J.; Balser, S.; Neuhaus, A.; Zickermann, V.; Kühlbrandt, W.; Terfort, A.; Rhinow, D. Self-Perforated Hydrogel Nanomembranes Facilitate Structural Analysis of Proteins by Electron Cryo-Microscopy. ACS nano 2017, 11, 6467–6473.
(2) Nogales, E. Profile of Joachim Frank, Richard Henderson, and Jacques Dubochet, 2017 Nobel Laureates in Chemistry. Proceedings of the National Academy of Sciences of the United States of America 2018, 115, 441–444.
(3) Terpe, K. Overview of tag protein fusions: From molecular and biochemical fundamentals to commercial systems. Applied microbiology and biotechnology 2003, 60, 523–533.
(4) Waugh, D. S. Making the most of affinity tags. Trends in biotechnology 2005, 23, 316–320.
(5) Brennan, J. L.; Hatzakis, N. S.; Tshikhudo, T. R.; Dirvianskyte, N.; Razumas, V.; Patkar, S.; Vind, J.; Svendsen, A.; Nolte, R. J. M.; Rowan, A. E. et al. Bionanoconjugation via click chemistry: The creation of functional hybrids of lipases and gold nanoparticles. Bioconjugate chemistry 2006, 17, 1373–1375.
(6) Fischler, M.; Sologubenko, A.; Mayer, J.; Clever, G.; Burley, G.; Gierlich, J.; Carell, T.; Simon, U. Chain-like assembly of gold nanoparticles on artificial DNA templates via 'click chemistry'. Chemical communications (Cambridge, England) 2008, 169–171.
(7) Parthasarathy, R.; Bajaj, J.; Boder, E. T. An immobilized biotin ligase: Surface display of Escherichia coli BirA on Saccharomyces cerevisiae. Biotechnology progress 2005, 21, 1627–1631.
(8) Jung, Y.; Jeong, J. Y.; Chung, B. H. Recent advances in immobilization methods of antibodies on solid supports. The Analyst 2008, 133, 697–701.
(9) Haab, B. B. Methods and applications of antibody microarrays in cancer research. Proteomics 2003, 3, 2116–2122.
(10) Sebastian Balser. Flow reactors based on physisorbed enzymes. Master Thesis, Goethe Universität Frankfurt, 2018.
(11) Sebastian Balser. Stabilisierung von Polyglycerolfilmen durch Quervernetzung. Bachelor Thesis, Goethe University Frankfurt, 2016.





 Sebastian Balser
Sebastian Balser